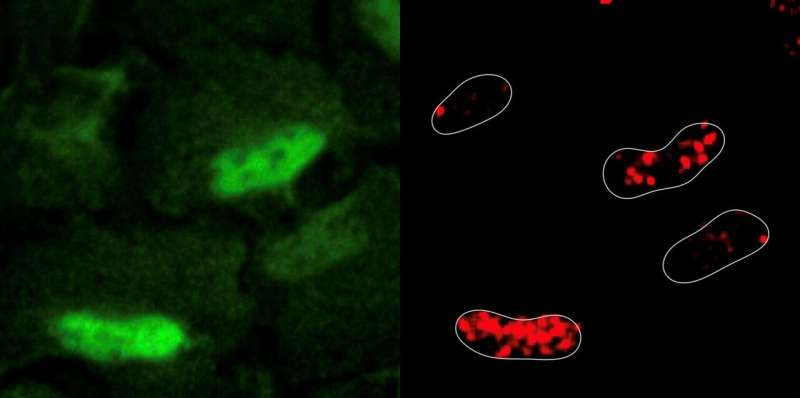
1 ژوئن 2023 – توسط مرکز تنظیم ژنومی-این تصویر محل آسیب DNA (در هسته این چهار سلول – سبز) و محلول شدن PRDX1 (در رنگ قرمز، همان مکان) را نشان می دهد. اعتبار: Sara Sdelci / CRG
یک سلول انسانی معمولی از نظر متابولیکی فعال است و با واکنشهای شیمیایی فعالیت میکند که مواد مغذی را به انرژی و محصولات مفیدی تبدیل و حیات را حفظ میکند. این واکنشها همچنین گونههای فعال اکسیژن را ایجاد میکنند، محصولات جانبی خطرناکی مانند پراکسید هیدروژن که به بلوکهای ساختمانی DNA آسیب میرسانند به همان روشی که اکسیژن و آب فلز را خورده و زنگ میزند. مشابه نحوه فروریختن ساختمان ها از اثر تجمعی زنگ، گونه های فعال اکسیژن یکپارچگی ژنوم را تهدید می کنند.
تصور میشود که سلولها نیازهای انرژی خود را با ظرافت متعادل میکنند و با داشتن فعالیت متابولیکی در خارج از هسته و درون سیتوپلاسم و میتوکندری از آسیب رساندن به DNA جلوگیری میکنند. آنزیم های آنتی اکسیدانی برای پاک کردن گونه های فعال اکسیژن در منبع خود قبل از رسیدن به DNA استفاده می شوند، یک استراتژی دفاعی که تقریباً از 3 میلیارد نوکلئوتید در برابر جهش های بالقوه فاجعه آمیز محافظت می کند. اگر آسیب DNA به هر حال رخ دهد، سلول ها لحظه ای مکث می کنند و تعمیرات را انجام می دهند، بلوک های ساختمانی جدید را سنتز می کنند و شکاف ها را پر می کنند.
علیرغم نقش مرکزی متابولیسم سلولی در حفظ یکپارچگی ژنوم، هیچ مطالعه سیستماتیک و بی طرفانه ای در مورد اینکه چگونه اختلالات متابولیک بر آسیب DNA و فرآیند ترمیم تأثیر می گذارد، انجام نشده است. این امر به ویژه برای بیماری هایی مانند سرطان که با توانایی آنها در ربودن فرآیندهای متابولیک برای رشد نامحدود مشخص می شود، مهم است.
یک تیم تحقیقاتی به سرپرستی سارا سدلچی در مرکز تنظیم ژنومیک (CRG) در بارسلونا و جوانا لویزو در مرکز تحقیقاتی CeMM برای پزشکی مولکولی آکادمی علوم اتریش در وین و دانشگاه پزشکی وین با انجام این کار به این چالش پرداخته اند. آزمایشهای مختلف برای شناسایی آنزیمها و فرآیندهای متابولیک برای پاسخ آسیب DNA سلول ضروری است. این یافته ها امروز در مجله Molecular Systems Biology منتشر شده است.
محققان با استفاده از یک داروی رایج شیمی درمانی به نام اتوپوزید به طور تجربی آسیب DNA را در رده های سلولی انسان القا کردند. اتوپوزید با شکستن رشته های DNA و مسدود کردن آنزیمی که به ترمیم آسیب کمک می کند، عمل می کند. به طور شگفت انگیزی، القای آسیب DNA منجر به تولید گونه های فعال اکسیژن و تجمع در داخل هسته شد. محققان مشاهده کردند که آنزیمهای تنفسی سلولی، منبع اصلی گونههای فعال اکسیژن، در پاسخ به آسیب DNA، از میتوکندری به هسته منتقل میشوند.
این یافته ها نشان دهنده یک تغییر پارادایم در زیست شناسی سلولی است زیرا نشان می دهد که هسته از نظر متابولیکی فعال است. جایی که دود وجود دارد، آتش وجود دارد، و هر جا که گونههای اکسیژن فعال وجود داشته باشد، آنزیمهای متابولیک در کار هستند. دکتر Sdelci، نویسنده مسئول این مطالعه و رهبر گروه در مرکز تنظیم ژنومی، می گوید: متابولیسم در سلول ها وجود دارد و در هسته یافت می شود.
محققان همچنین از CRISPR-Cas9 برای شناسایی تمام ژنهای متابولیکی که برای بقای سلول در این سناریو مهم بودند، استفاده کردند. این آزمایشها نشان داد که سلولها به آنزیم PRDX1، یک آنزیم آنتیاکسیدانی که معمولاً در میتوکندری نیز یافت میشود، سفارش میکنند تا به سمت هسته حرکت کند و گونههای اکسیژن فعال موجود را برای جلوگیری از آسیب بیشتر حذف کند. همچنین مشخص شد که PRDX1 با تنظیم در دسترس بودن سلولی آسپارتات، ماده خامی که برای سنتز نوکلئوتیدها، بلوک های سازنده DNA، حیاتی است، آسیب را ترمیم می کند.
PRDX1 مانند یک پاک کننده رباتیک استخر است. سلول ها شناخته شده اند که از آن برای تمیز نگه داشتن درون خود و جلوگیری از تجمع گونه های فعال اکسیژن استفاده می کنند، اما قبلا در سطح هسته ای نبوده است. این شواهدی است که در شرایط بحرانی، دکتر Sdelci می گوید: هسته با استفاده از ماشین آلات میتوکندری پاسخ می دهد و یک سیاست صنعتی سریع اضطراری را ایجاد می کند.
این یافته ها می تواند خطوط آینده تحقیقات سرطان را راهنمایی کند. برخی از داروهای ضد سرطان، مانند اتوپوزید مورد استفاده در این مطالعه، سلول های تومور را با آسیب رساندن به DNA و مهار فرآیند ترمیم از بین می برند. اگر آسیب کافی جمع شود، سلول سرطانی فرآیندی را آغاز می کند که در آن خود تخریب می شود.
در طول آزمایشات خود، محققان دریافتند که از بین بردن ژن های متابولیک حیاتی برای تنفس سلولی – فرآیندی که از اکسیژن و مواد مغذی انرژی تولید می کند – باعث می شود سلول های سالم در برابر اتوپوزید مقاوم شوند. این یافته مهم است زیرا بسیاری از سلول های سرطانی گلیکولیتیک هستند، به این معنی که حتی در حضور اکسیژن نیز بدون انجام تنفس سلولی انرژی تولید می کنند. این بدان معناست که اتوپوزید و سایر شیمیدرمانیها با مکانیسم مشابه، احتمالاً تأثیر محدودی در درمان تومورهای گلیکولیتیک دارند.